أحماض أمينية. تأين ومعايرة Amino-acids. Ionization, titration
يؤدي تأين الأحماض الأمينية عند درجة حموضة محددة إلى ظهور عدة أشكال جزيئية موجبة أو سالبة الشحنة أو ذات شحنة كهربائية إجمالية تساوي الصفر. تعكس منحنيات معايرة الأحماض الأمينية (amino-acid titration) تركيبة محلول الحمض الأميني في هذا الشكل الجزيئي أو ذاك.
The ionization of amino-acids at precise pH gives rise to several positively or negatively charged molecular forms or other forms with zero overall electric charge.
The titration curves reflect the composition of the amino acid solution in different molecular forms.
ما هي خاصية التأين التي تمتاز بها الأحماض الأمينية؟
What is the ionization character of amino-acids ?
تعتبر الأحماض الأمينية كعديدي الأحماض (polyacids) تفرز بروتوتات (H+ = H3O+) بقدر ما لها من مجموعة تأينية (ionizable groups). تمتاز كل من الأحماض الأمينية المتعادلة (Neutral amino-acids، مثل الجليسين و الألنين) والأحماض الأمينية ذات الشحنة الموجبة (أحماض أمينية قاعدية كالليزين و الأرجينين) والأحماض ذات الشحنة السالبة (أحماض ثنائية الكربوكسيل أو أحماض أمينية حمضية كالحمض الأسبارتي و الحمض الجلوتامي) بأشكال تأينية مختلفة نظرا لتوفرها على اثنين أو ثلاثة مجموعات قابلة للتأين، إثر تغير حموضة الوسط. تكمن المجموعات التأينية في مجموعة الكاربوكسيل المحمولة فوق الكاربون ألفا (a)، و هي أكثر حامضية و مجموعة الكاربوكسيل فوق الشق R (عند الحمض الكلوتامي والحمض الأسبارتي) ومجموعة الأمين الموجودة فوق الكاربون ألفا ثم مجموعة الأمين فوق الشق R (عند الليزين والأرجنين، مثلا).
ماذا تعني معايرة الأحماض الأمينية؟
What does amino-acid titration mean?
تميل معايرة حمض أميني ما إلى إظهار أشكال التأين المختلفة للحمض الأميني وأرقام الحموضة (pH) التي تحدث فيها بيانيًا. ويتم ذلك بطريقتين:
1/ مراقبة تفكك الحمض الأميني (المشبع سابقاً بحمض) باستعمال قاعدة ونحصل على منحنى التفكك
2/ مراقبة تشبع الحمض الأميني (المفكك سابقاً بقاعدة) بواسطة حمض. نحصل على منحنى التشبع.
.

تأين الأحماض الأمينية المتعادلة
Ionization of neutral amino-acids
تتميز الأحماض الأمينية المتعادلة بعدم وجود أي شحنة كهربائية يحملها جذري R. عند الحموضة العالية (الرقم الهيدروجيني = 1)، يكون الحمض الأميني مشبعًا تمامًا بالبروتونات ويحمل شحنة كهربائية موجبة (+). مع الإضافة التدريجية لقاعدة (مثل NaOH)، تبدأ مجموعة الكربوكسيل التي يحملها كربون ألفا (a) (المجموعة الأكثر حمضية، pk المنخفض)، أولاً في الانفصال وبالتالي تفقد بروتونها. ثم يأتي دور المجموعة الأمينية (pk الأعلى) والتي بدورها تفقد بروتونًا وتصبح عديمة الشحنة (لأن الحمض الأميني المنفصل تمامًا مشحون بـ +). في النهاية، سيكون للحمض الأميني شحنة كهربائية سالبة (-) عند pH مرتفع جدًا (وسط قاعدي) (انظر الرسم التالي).
بالنظر إلى التوازن الأول (إطلاق البروتون بواسطة الكربوكسيل)، يمكن حساب ثابت التوازن K1 (ثابت التفكك)، وهو:
K1 = (H+) (A+)/(A+)
بالنسبة للحمض الكربوكسيلي:
10-4M<K1<10-6M
وبالنظر إلى التوازن الثاني (فقد البروتون من المجموعة الأمينية)، فمن الممكن حساب ثابت التوازن K2، وهو:
K2 = (H+) (A-)/(A+)
للأمين:
10-8M<K2<10-10M
بشكل عام:
(جزيء غير منفصل، حمض) / (جزيء منفصل، قاعدة) (H+) = K
تظل نسبة الجزيئات المنفصلة وغير المنفصلة مرتبطة بتركيز البروتون H+ (معبرًا عنه بالرقم الهيدروجيني).
إذا كان pH = 7، أي (H+) = 10-7، تصبح ثوابت التوازن K1
و K2 على النحو التالي:
- حالة K1 = 10-5 M:
(A+)/(A+) = 10-5/10-7=100,
لـ 100 جزيء أساسي (A+)
هناك جزيء حمض (A+).
- الحالةK2
= 10-9 M:
(A-)/(A+) = 10-9/10-7= 1/100، لكل جزيء أساسي (A-)
هناك 100 جزيء حمض A+)).
استنادا إلى مفهوم الرقم الهيدروجيني (اللوغاريتم). تركيز أيون الهيدروجين السالب، pH = -log10 (H+)، نستنتج:
عندما يكون الرقم الهيدروجيني مكافئًا لـ pK، يصبح تركيز الجزيء المفكك مساويًا لتركيز الجزيء غير المفكك. يُطلق على الرقم الهيدروجيني في هذه الحالة اسم "pH نصف التفكك". وهو يعبر عن قوة الحمض، أي سهولة تخلصه من بروتونه. على سبيل المثال: pK1أصغر من pK2، يعني أن الحمض 1 أقوى من الحمض 2.
Download 'Ionisation des acides aminés neutres' (Ar, Fr).
الرقم الهيدروجيني للتساوي الأيوني (pI، pHi) للأحماض الأمينية
Isoelectric pH (pI, pHi) of amino acids
الرقم الهيدروجيني الأيزويوني (pHi) للأحماض الأمينية: تفكك الوظائف تولد الأشكال القابلة للتأين من الأحماض الأمينية أشكالًا مختلفة من نفس الحمض الأميني بشحنات كهربائية مختلفة. يتم تحديد الرقم الهيدروجيني للمحلول الذي يوجد فيه الحمض الأميني عند اكتساب الشحنات. يُطلق على الرقم الهيدروجيني الذي تكون فيه الشحنة الكهربائية الصافية الإجمالية صفرًا (بالتزامن مع النموذج A+-) الأس الهيدروجيني للمتساوي الأيوني (pHi) أو الأس الهيدروجيني للمتساوي الكهربي (pI).
احتساب pHi للأحماض الأمينية المتعادلة
Calculation of pHi for neutral amino acids.

قيمة الرقم الهيدروجيني pHi هي متوسط قيمتي pK لشكلي الحمض الأميني المحيطين بالشكل -+A مع شحنة كهربائية صفر (الشكل حيث pHi = pH ). على سبيل المثال، قيمة الرقم الهيدروجينيi للجليسين، 5.97 تمثل متوسط pK1 (2.34)و pK2 (9.60). عند النقطة pHi = pH، يكون الحمض الأميني على صورة A+(100%). عند pH = pK1، يكون الحمض الأميني في الأشكال: A+ (50%)و A+ (50%). عند pH = pK2، يكون الحمض الأميني في الأشكال: A+ (50%)و A- (50%).
منحنى معايرة الأحماض الأمينية المتعادلة
Titration curve of neutral amino acids
تهدف معايرة الأحماض الأمينية إلى معرفة ثوابت pK لأشكال الحمض الأميني المتأين بعد إضافة تراكيز قياسية معينة من قاعدة (NaOH، مثلا ) أو حمض ( HCl، مثلا ) مع مراقبة تغير pH.
تمتاز كل من الأحماض الأمينية المتعادلة والأحماض ذات الشحنة السالبة (أحماض أمينية ثنائية الكربوكسيل) والأحما الأمينية ذات الشحنة الموجبة (أحماض أمينية قاعدية) بمنحنيات للمعايرة مختلفة.
منحنى معايرة الجليسين
Titration curve of Glycine

فيديو: تأين
ومعايرة الأحماض الأمينية المحايدة. مثال الوستارية
Video: Ionization and titration of neutral amino acids. Example of Glycine (video in Ar and Fr):
كيف تفسر مناطق منحنى معايرة الجليسين المتميزة بتغيرات طفيفة في pH رغم إضافة القاعدة ؟
تعتبر منطقتي منحنى معايرة الكليسين المتميزتان بتغير طفيف في pH رغم إضافة القاعدة، منطقتان منظمتان (Buffer zones). و هي توجد حول نقاط pK (مناطق نصف تفكك مجموعات الكربوكسيل و الأمين، half-dissociation zones). لكل الأحماض الأمينية قدرة على العمل كمحاليل منظمة (Buffer solutions) و تكون قدرتها على التنظيم أعلى عندما يكون تركيز واهب البروتون يساوي تركيز مستقبل البروتون.
Share this information on social media تبادل المعلومة عبر المواقع الإجتماعية
 |
 |
 |
 |
 |
فيديو: تأين
ومعايرة الأحماض الأمينية المحايدة. مثال الوستارية
Video: Ionization
and titration of neutral amino acids. Example of Glycine (video in Ar and Fr):
تأين الأحماض الأمينية ذات الشحنة السالبة (أحماض أمينية ثنائية الكربوكسيل، أحماض أمينية
حمضية)
Ionization of negatively charged amino acids (dicarboxylic amino acids, amino acids
acidic)
في هذه الحالة تضاف مجموعة تأينية ثالثة للمجموعات المعتادة (الكاربوكسيل فوق Ca والأمين). إنها مجموعة كاربوكسيل الشق R. هكذا تصبح معادلات التأين:

في حالة تأين الأحماض الأمينية ثنائية الكاربوكسيل مثل الحمض الجلوتامي، يقع pHi (شكل الحمض الأميني A+) وسط الثابتين pK1 و pKR المتعلقين بتفكك المجموعة الكربوكسيلسة ل Ca ونظيرتها فوق الشق R.
إحتساب pHi للأحماض الأمينية ذات الشحنة السالبة (أحماض أمينية ثنائية الكربوكسيل).

منحنى معايرة الأحماض الأمينية ذات الشحنة السالبة (أحماض أمينية ثنائية الكربوكسيل).

تعتبر معايرة المجموعة الكربوكسيلية للشق R بإضافة NaOH نقطة التعادل الوحيدة (V1) التي يسهل كشفها بوضوح إبان قياس pH. عند نقطة pKR = pH، يكون الحمض الأميني في شكل A+ (50%) و A+2- (50%). قيمة pHi لحمض الجلوتامي 3,2 تمثل معدل pK1 (2,2) و pKR (4,3). أما قيمة pK2 فهي 9,7.
Download 'Ionisation
des acides aminés dicarboxyliques' (Ar, Fr).
فيديو (باللغة العربية والفرنسية). تأين ومعايرة الأحماض الأمينية الحمضية. مثل الحمض الجلوتامي:
Video (Ar and Fr). Ionization and titration of acidic amino acids. Example of glutamic acid:
تأين الأحماض الأمينية ذات الشحنة الموجبة (أحماض أمينية قاعدية)
Ionization of positively charged amino acids (basic amino acids)

إحتساب pHi للأحماض الأمينية ذات الشحنة الموجبة (أحماض أمينية قاعدية).

منحنى معايرة الأحماض الأمينية ذات الشحنة الموجبة (أحماض أمينية قاعدية).

تعتبر معايرة مجموعة الأمين فوق Ca بإضافة HCl،
نقطة التعادل الوحيدة (V'1) التي
يسهل كشفها بوضوح إبان قياس pH.
عند نقطة pKR = pH، يكون الحمض الأميني في شكل A+ (50%) و A- (50%). قيمة pHi
لليزين 9,8 تمثل معدل pK2 (9,0) و pKR
(10,5). أما قيمة pK1 ، فهي 2,2. بالنسبة
للأرجنين (= 10,8 pHi)، قيمة pK1
تساوي 2,2، = 9,0pK2و pKR =
12,5. أما الهستدين فتتميز، عكس الليزين و
الأرجينين، بتفكك مجموعة إميدازول (شق
R) قبل تفكك مجموعة الأمين مع = 7,6 pHi
و بثوابت pK1 و pK2 و pKRتساوي
بالتتالي 1,8 و 9,2 و 6,0.
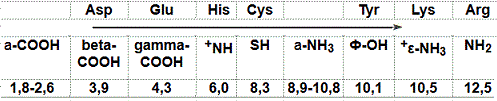
مقارنة
لتأين مختلف أنواع الأحماض الأمينية
Comparison of the ionization of different types of amino acids

مقارنة لقيم pK للمجموعات التأينية لكل الأحماض الأمينية
Comparison of pK values for the ionization groups of each amino acid
LIENS UTILES
- STRUCTURES of PROTEINS بنيات البروتينات
- QCM Acides aminés ionisation
- Acides aminés à chaîne hydrocarbonnée
- - Acides aminés hydroxylés -
- Acides aminés soufrés
- Acides aminés basiques
- Acides aminés dicarboxyliques
- Acides aminés cycliques
- Ionisation des acides aminés. Exercices
- Acides aminés. Structure et propriétés (QCM)
- Présentation du livre
- Affiche du livre



